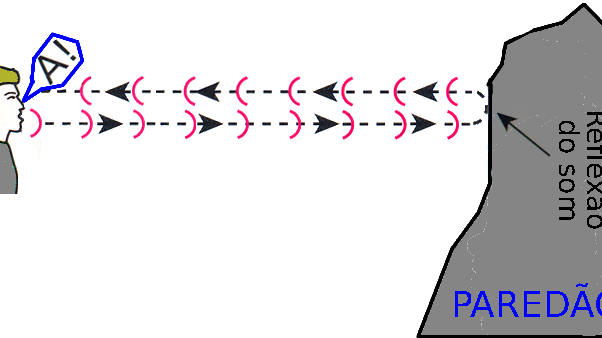
Símbolo: Cs
Número atómico: 55
Ponto de fusão: 28,44 °C
Descobrimento: 1860
Ponto de ebulição: 670,8 °C
- O Césio - 133 é utilizado na construção de relógios atómicos
- O Césio - 134 foi usado na hidrologia como medida de determinação da produção de césio nas indústrias de energia nuclear. Este isótopo de césio é usado com essa finalidade porque, apesar de ser menos comum que o Césio - 133 ou o Césio - 137, é produzido unicamente por reações nucleares. O Césio - 135 também foi usado com essa função.
- Da mesma maneira que os outros elementos do grupo 1 , o césio tem uma grande afinidade pelo oxigénio e, por isso, é usado como "getter " em tubos de vácuo.
- Este metal também é usado em células fotoeléctricas porque ioniza-se quando exposto a luz.
- É usado como catalisador na hidrogenação de certos compostos orgânicos.
- Isótopos radioativos de césio são usados no campo médico para tratar de certos tipos de cancro.
- O fluoreto de césio é usado extensivamente na química orgânica como base e como fonte de iões fluoretos.
- Este metal tem sido usado mais recentemente em sistemas de propulsão iónica.










![[modelo-atomico-de-dalton-1.jpg]](https://blogger.googleusercontent.com/img/b/R29vZ2xl/AVvXsEgUCb2uaVriUNfq6Lnqzbplt62RYV1Fedx1DLU6sPhlcKhfp_5xb1JdWPzvGbzR6UQrEjxUQVpk7v4O3La1V5RTlSW3vy0usMTtaRR4u1-rnIHN9fAYkmhPnomyiP521iUfGf16a7k1CEn6/s200/modelo-atomico-de-dalton-1.jpg)