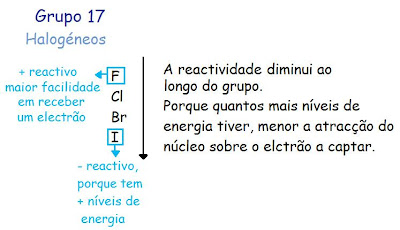
À medida que a nuvem electrónica aumenta, os electrões de valência encontram-se mais afastados do núcleo, diminuindo a atração do núcleo fica mais fácil "sair" do átomo, por isso são mais reactivos.
Tamanho dos átomos:
- Ao longo do grupo o tamanho dos átomos aumenta, porque aumenta o número de níveis de energia.
- Ao longo do período o tamanho diminui, porque o nº de electrões aumenta no mesmo nível de energia, o que provoca uma contracção da nuvem electrónica.
 |
| Tamanho dos átomos na tabela periódica |




![[modelo-atomico-de-dalton-1.jpg]](https://blogger.googleusercontent.com/img/b/R29vZ2xl/AVvXsEgUCb2uaVriUNfq6Lnqzbplt62RYV1Fedx1DLU6sPhlcKhfp_5xb1JdWPzvGbzR6UQrEjxUQVpk7v4O3La1V5RTlSW3vy0usMTtaRR4u1-rnIHN9fAYkmhPnomyiP521iUfGf16a7k1CEn6/s200/modelo-atomico-de-dalton-1.jpg)


